REFERÊNCIA:
http://www.colegioweb.com.br/quimica/niveis-energeticos-ou-camadas-eletronicas-.html
01/06/2012 10:21
Níveis energéticos ou camadas eletrônicas
8. Camadas eletrônicas ou níveis energéticos
Existem elétros que estão um pouco mais perto do núcleo, chegamos a essa conclusão pelo fato de que alguns elétrons são mais fáceis de serem removidos que outros. Isso ocorre por que quanto mais perto do núcleo o elétron estiver, mais força da sua energia potenial ele irá perder, e a energia cinética aumenta, aumentando assim sua velocidade.
Isso varia de acordo com a distância em que o elétron está em relação ao núcleo, a medida em que o elétron se movimenta e se afasta do núcleo ele perde energia, essa energia é retornada em forma de radiação, que podemos medir pela cor que varia de acordo com a frequência da energia.
É possível acontecer 7 níveis de energia, e são denominados números quânticos principais, no qual sua função é mostrar a distância entre o elétron e o núcleo. Os números quânticos principais são:
K, L, M, N, O, P, Q ou 1, 2, 3, 4, 5, 6, 7
Na equação de Rydberg, o número de elétron em determinada camada é representado por X e o número quântico principal equivalente a essa camada é representado por n.
Equação: X = 2 . n2
Onde X representa o número de elétrons em certa camada, e n representa o número quântico que corresponde a essa mesma camada.
Observe as camadas com as equações aplicadas:
Se aplica a fórmula até a camada N, e os átomos dos elétrons até o
número atômico Z=118. Observe em cada camada há um número máximo de
elétrons.
O número máximo de elétrons que a camada O pode ter são 50 elétrons, porém até agora na camada O só há 32 elétrons.
Observe:
Z = 17 A = 35
Número de prótons: Z = 17
Número de elétrons: Z = 17
Número de nêutrons: N = A – Z = 35 – 17 = 18
A distribuição eletrônica
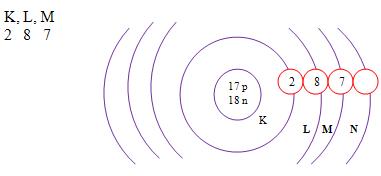
Camada de valência
É representada pela letra M, só tem capacidade para 8 elétros não mais que isso, e é o nível de energia do átomo que mais está no seu exterior.
Regras práticas de distribuição eletrônica
- É necessário organizar na ordem, K, L, M, N, O, P, Q… até Z, que é o número atômico.
- Quando tiver mais que 8 elétrons, na última camada, temos que colocar um número menor entre 2, 8, 18, 32, passando a diferença para o nível seguinte.Lembrando que não pode ter mais que 18 elétrons no penúltima camada.
Observe os exemplos:
1) Número atômico 20
2) Número atômico 53
Existem elétros que estão um pouco mais perto do núcleo, chegamos a essa conclusão pelo fato de que alguns elétrons são mais fáceis de serem removidos que outros. Isso ocorre por que quanto mais perto do núcleo o elétron estiver, mais força da sua energia potenial ele irá perder, e a energia cinética aumenta, aumentando assim sua velocidade.
Isso varia de acordo com a distância em que o elétron está em relação ao núcleo, a medida em que o elétron se movimenta e se afasta do núcleo ele perde energia, essa energia é retornada em forma de radiação, que podemos medir pela cor que varia de acordo com a frequência da energia.
É possível acontecer 7 níveis de energia, e são denominados números quânticos principais, no qual sua função é mostrar a distância entre o elétron e o núcleo. Os números quânticos principais são:
K, L, M, N, O, P, Q ou 1, 2, 3, 4, 5, 6, 7
Na equação de Rydberg, o número de elétron em determinada camada é representado por X e o número quântico principal equivalente a essa camada é representado por n.
Equação: X = 2 . n2
Onde X representa o número de elétrons em certa camada, e n representa o número quântico que corresponde a essa mesma camada.
Observe as camadas com as equações aplicadas:
|
K
|
L
|
M
|
N
|
O
|
P
|
Q
|
|
2
|
8
|
18
|
32
|
50
|
72
|
98
|
| K | L | M | N | O | P | Q |
| 2 | 8 | 18 | 32 | 32 | 18 | 8 |
Observe:
Z = 17 A = 35
Número de prótons: Z = 17
Número de elétrons: Z = 17
Número de nêutrons: N = A – Z = 35 – 17 = 18
A distribuição eletrônica

Camada de valência
É representada pela letra M, só tem capacidade para 8 elétros não mais que isso, e é o nível de energia do átomo que mais está no seu exterior.
Regras práticas de distribuição eletrônica
- É necessário organizar na ordem, K, L, M, N, O, P, Q… até Z, que é o número atômico.
- Quando tiver mais que 8 elétrons, na última camada, temos que colocar um número menor entre 2, 8, 18, 32, passando a diferença para o nível seguinte.Lembrando que não pode ter mais que 18 elétrons no penúltima camada.
Observe os exemplos:
1) Número atômico 20
|
K
|
L
|
M
|
N
|
|
2
|
8
|
10
|
2
|
|
|
|
8
|
|
K
|
L
|
M
|
N
|
O
|
|
2
|
8
|
18
|
25
|
7
|
|
|
|
|
18
|














.jpg)











